Follikelstimulation
Die Follikelstimulation ist eine der wichtigsten Behandlungsmassnahmen bei der assistierten Reproduktion. Hierbei werden Hormon-basierte Medikamente verabreicht, um eine follikuläre Entwicklung und den Eisprung von reifen Eizellen zu ermöglichen. Je nach Art der geplanten Therapieform werden dabei unterschiedliche Medikamente in unterschiedlicher Dosierung verabreicht. Die Verabreichung und Dosierung dieser Medikamente hängen dabei von individuellen Faktoren der Patientin ab. Diese können auch im Laufe der Therapie anhand von Ultraschallkontrollen oder aufgrund der Bestimmung bestimmter Hormonspiegel im Blut angepasst werden.
Eine Follikelstimulation erfolgt bei fast allen reproduktionsmedizinischen Behandlungen, sei es bei einer intrauterinen Insemination (IUI) –wenn diese nicht im Spontanzyklus erfolgt– als auch bei einer IVF-Behandlung
Je nach Zielsetzung kommen dabei unterschiedliche Stimulationsprotokolle zum Einsatz.
Dabei handelt es sich um einen Prozess, bei dem die Patientin hormonelle Medikamente gespritzt werden, um den Eisprung zu stimulieren und zu kontrollieren.
Wie funktioniert der weibliche Zyklus?
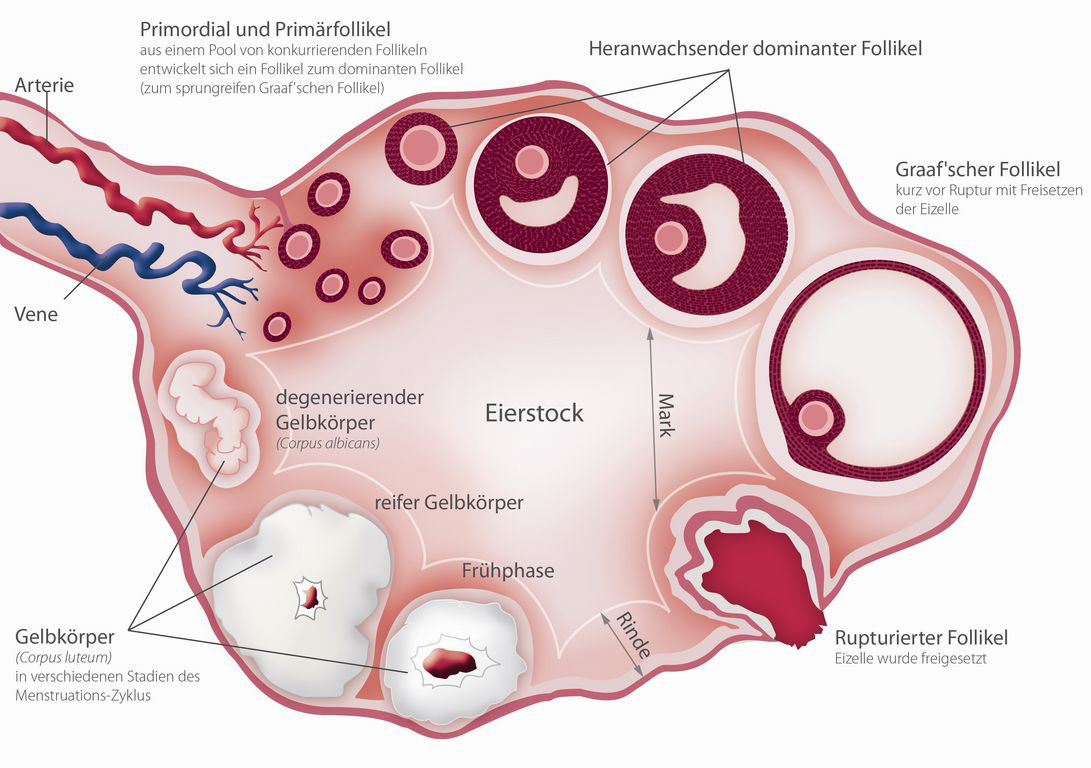
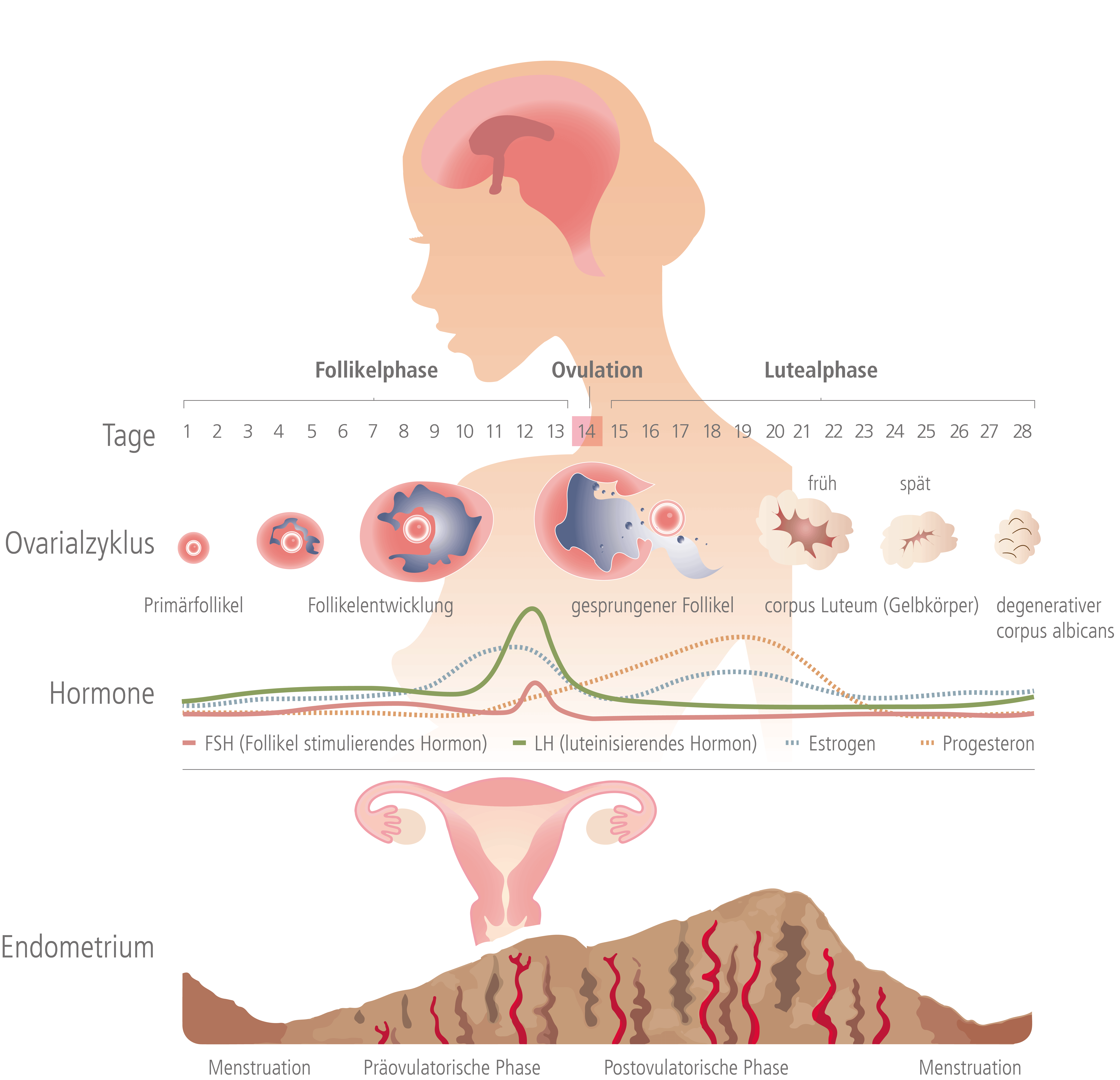
Normalerweise reift in jedem (natürlichen) Zyklus der Frau monatlich jeweils eine Eizelle heran. Zu Beginn steht die Wachstumsphase, in der einige wenige Follikel heranwachsen. Diese Follikel stellenbläschenartige Gebilde dar, in denen die Eizelle heranreift. Im Durchschnitt konkurrieren in einem Zyklus 10 bis 20 Follikel um die Dominanz. In der Regel wird aber nur ein Follikel wird zum Leitfollikel, der auch ausreift und die Eizelle in den Eileiter freisetzt. Der Rest der Follikel degeneriert und die Eier in ihnen gehen verloren. Bei der natürlichen Konzeption erfolgt nach dem Koitus eine Verschmelzung der Eizelle mit einem Spermium (Befruchtung). Die befruchtete Eizelle beginnt sich zu teilen und weiterzuentwickeln. Gleichzeitig wandert diese in Richtung der Gebärmutter und erreicht diese etwa am 5 Tag nach der Befruchtung im sogenannten Blastozystenstadium. Im Idealfall findet die Blastozyste ein rezeptives (empfängliches) Endometrium vor. Damit beginnt die Einnistung des Embryos und eine Schwangerschaft entsteht. Die Follikelreifung und der Eisprung sind dabei hormongesteuert. Konkret erfolgt dies aus einem fein abgestimmten Wechselspiel zwischen Hypothalamus -einer wichtigen Schaltzentrale im Gehirn, der Hypophyse, ein endokrines Organ, das ebenfalls im Zentralen Nervensystem sitzt und den Ovarien (Eierstöcken)
Das Hormon Follikelstimulierendes Hormon (FSH) ist, wie der Name schon impliziert, für die Stimulation der Follikelentwicklung verantwortlich. Nach 7-8 Tagen Follikelwachstum sinkt der FSH-Spiegel und nur der dominante ist in der Lage zu überleben und weiter zu reifen. In der Zyklusmitte, etwa um den 14. Zyklustag, kommt es einen Anstieg des Luteinisierenden Hormons (LH). Bei der höchsten LH-Konzentration, dem sogenannten LH-Peak, wird der den Eisprung auslöst. Der Follikel im Eierstock bricht und die Eizelle wird in den Eileiter ausgestoßen.
Es existiert auch eine hormonelle Störung, bei der eine Eizellreifung und ein Eisprung unterbleibt. Man spricht von einem sogenannten polyzystische Ovarialsyndrom kurz PCOS.
Medikamente zur Stimulation
Im Prinzip geht es bei der hormonellen Stimulation im Rahmen assistierter Reproduktionsmassnahmen die natürlichen hormonellen Steuerungsprozesse nachzuahmen. Dies wird durch eine Reihe Hormonbasierter oder Hormonähnlicher Substanzen erreicht.
Dazu zählen:
GnRH-Analoga: Sie dienen der Unterdrückung der Eierstöcke, d.h. sie hemmen die endogenen Geschlechtshormone des Menstruationszyklus.
Gonatropin-basierte Medikamente: Diese steuern die Entwicklung der Follikel
Clomifen: Dies ist ein Östrogenrezeptormodulator. Durch eine Östrogenrezeptorblockade auf Hypophysenebene kommt es zu vermehrter Gonadotropinausschüttung und damit zur ovariellen Stimulation.
Letrozol: Letrozol ist ein Arzneistoff aus der Gruppe der Aromatasehemmer und wirkt ähnlich dem Clomiphen
Ovulationsinduktoren: Diese leiten die finale Eizellreifung und den Eisprung ein.
Je nach Wirkstoff bzw. Medikament erfolgt eine Verabreichung subkutan (unter die Haut) oder intramuskulär (in den Muskel injiziert).
Je nach Indikation gibt es unterschiedliche Formen der kontrollierten ovariellen Stimulation.
Man unterscheidet generell zwischen nicht-konventionellen Stimulationsschemata – unter diese fallen sogenannte Low-Dose Stimulationen; Clomiphencitrat oder Letrozol-basierte Schemata- und konventionelle Stimulationsprotokolle. Diese umfassen wiederum die Agonisten Protokolle (kurzes oder langes Protokoll – englisch: short / long protocol) und das GnRH Antagonistenprotokoll. Erstere dienen der IUI, bei der möglichst nur ein Follikel reifen sollte, um Mehrlingsschwangerschaften zu vermeiden.
Bei den konventionellen Stimulationsschemata geht es hingegen darum möglichst viele Follikel weiterwachsen zulassen, damit darin Eizellen heranreifen können, die dann mittels Follikelpunktion gewonnen werden können und anschliessend entweder über eine IVF oder eine ICSI / IMSIbefruchtet werden können.
- GnRH-Analoga: Sie dienen der Unterdrückung der Eierstöcke, d.h. sie hemmen die endogenen Geschlechtshormone des Menstruationszyklus.
- Gonatropin-basierte Medikamente: Diese steuern die Entwicklung der Follikel
- Clomifen: Dies ist ein Östrogenrezeptormodulator. Durch eine Östrogenrezeptorblockade auf Hypophysenebene kommt es zu vermehrter Gonadotropinausschüttung und damit zur ovariellen Stimulation.
- Letrozol: Letrozol ist ein Arzneistoff aus der Gruppe der Aromatasehemmer und wirkt ähnlich dem Clomiphen
- Ovulationsinduktoren: Diese leiten die finale Eizellreifung und den Eisprung ein.
Je nach Wirkstoff bzw. Medikament erfolgt eine Verabreichung subkutan (unter die Haut) oder intramuskulär (in den Muskel injiziert).
Je nach Indikation gibt es unterschiedliche Formen der kontrollierten ovariellen Stimulation.
Man unterscheidet generell zwischen nicht-konventionellen Stimulationsschemata – unter diese fallen sogenannte Low-Dose Stimulationen; Clomiphencitrat oder Letrozol-basierte Schemata- und konventionelle Stimulationsprotokolle. Diese umfassen wiederum die Agonisten Protokolle (kurzes oder langes Protokoll – englisch: short / long protocol) und das GnRH Antagonistenprotokoll. Erstere dienen der IUI, bei der möglichst nur ein Follikel reifen sollte, um Mehrlingsschwangerschaften zu vermeiden.
Bei den konventionellen Stimulationsschemata geht es hingegen darum möglichst viele Follikel weiterwachsen zulassen, damit darin Eizellen heranreifen können, die dann mittels Follikelpunktion gewonnen werden können und anschliessend entweder über eine IVF oder eine ICSI / IMSIbefruchtet werden können.
Vor der Stimulation
Ein Therapieplan wird für jede Patientin individuell festgelegt und je nach Follikelwachstum und auch nach Verträglichkeit und Ansprechen der Eierstöcke während der Stimulation ständig angepasst.
Das Therapieschema ergibt sich dabei durch die Art der Infertilität, dem weiblichen Alter, möglichen Vorbehandlungen, der zuvor bestimmten ovariellen Reserve, BMI, Hormonparametern, usw.
Die Erfolgswahrscheinlichkeit des Ansprechens einer Stimulation, sowie die Gefahr einer potenziellen Überstimulation (ovarielles Hyperstimulationssyndrom, kurz OHSS) sind dabei wesentliche Parameter zur Festlegung des Stimulationsprotokolles.
Das lange Protokoll (Long Protocol) ist gut planbar. Es erlaubt ein sehr gutes synchronisiertes Follikelwachstum und damit eine hohe Rate an reifen Eizellen bei der Punktion. Die Frau beginnt bereits zwischen Tag 21 und 23 des Vorzyklus mit einer sogenannten Downregulation, um die GnRH-Sekretion zu unterdrücken. Danach beginnt die eigentliche Stimulation.
Bei normaler Ovarialfunktion ist die Stimulation stark und die Gefahr eines Abbruches gering. Gleichzeitig zeigt sich das Endometrium unter der GnRH-Stimulation deutlich besser als beim Antagonisten Protokoll. Ein Embryotransfer im gleichen Zyklus (Frischtransfer) ist bei Ausschluss eines OHSS möglich.
Beim kurzen Protokoll (Short Protocol) beginnt die Downregulation erst zu Beginn des Stimulationszyklus. Durch den sogenannten “Flare-up– Effekt” zu Beginn der Wirkung der GnRH-Agonisten – eine anfängliche Stimulation der GnRH-Sekretion, die nach einiger Zeit in eine komplette Unterdrückung übergeht –soll so bei sogenannten “Low-Responder Patientinnen” eine ausreichende Stimulation gewährleistet werden. Nachteilig ist unter anderem die vermehrte Zystenbildung.
Beim Antagonisten-Protokoll kommen GnRH-Antagonisten, Wirkstoffe, die als kompetitiveAntagonisten am GnRH-Rezeptor wirken und die Ausschüttung der Gonadotropine LH und FSH unterdrücken, zum Einsatz. Der Vorteil ist das geringere Risiko einer Überstimulation. Im Gegensatz zum den Agonisten-Protokollen kann bei der finalen Eizellreifung auf HCG verzichtet werden. Stattdessen wird ein Agonist wie etwa Decapeptyl verwendet. Nachteilig sind Nebeneffekte auf das Endometrium, die in der Regel keinen Frischtransfer erlauben, sondern einen Kryotransfer nötig machen. Auch ist das Follikelwachstum nicht so synchron wie beim Long Protokoll und auch die Wahrscheinlichkeit eines Scheiterns der Entnahme reifer Eizellen trotz adäquater Stimulation aufgrund des Agonisten-Triggers – wenn auch insgesamt nicht sehr hoch- höher (sogenanntes unechtes «empty follicle Syndrome»)
Voruntersuchungen
Die Stimulation bedarf einer entsprechenden Vorbereitung. Zum einen müssen spezielle Hormonwerte im Blut bestimmt werden. Zum anderen erfolgt mittels Ultraschalluntersuchung die Bestimmung des sogenannten „Antralen Follikel Counts“ – kurz AFC (= Anzahl der im Ultraschall sichtbaren kleinenund stimulierbaren Follikel). Bei der AFC-Bestimmung werden alle antralen Follikel beider Ovarien mit einem Durchmesser zwischen 2 und 10 mm mittels Ultraschalls erfasst. Im Rahmen dieser Untersuchung werden die inneren weiblichen Genitalien, wie auch der Uterus (Gebärmutter) auf mögliche Pathologien untersucht, wie etwa auf Myome, Polypen oder uterine Verwachsungenuntersucht.
Hilfe bei der Stimulation
Vor und während der Behandlung ist das Kinderwunschpaar oftmals mit vielen Eindrücken und Informationen konfrontiert. Manchmal kann dies verwirrend sein, oder gar Ängste hervorrufen, eventuell etwas falsch zu machen. Dies gilt im besonderen Masse für die Hormoninjektion, welche das Paar, nach der entsprechenden Aufklärung und Unterweisung im Kinderwunschzentrum zuhause selbst durchführt.
Nur wenn die Stimulation erfolgreich war und Eizellen nach der Follikelpunktion vorhanden sind, können, die weiteren Massnahmen gesetzt werden. Daher muss die Hormontherapie sehr genau umgesetzt werden. Dies wird anhand eines von uns individuell festgelegten Stimulationsplans gewährleistet. Hierdurch wird ersichtlich, welches Medikament wann und wie verabreicht werden muss. Zudem helfen Ihnen unsere Video-Tutorials zur korrekten Vorbereitung und Injektion der Medikamente .
Einnahme der Medikamente
Die Eierstöcke der Frau werden mit der gezielten Gabe von Hormonen stimuliert. Hierfür gibt es verschiedene Medikamente. Jene Hormonpräparate, die mittels Spritze verabreicht werden müssen, sind je nach Medikament auf unterschiedliche Weise zu injizieren: in den Muskel (intramuskuläre Injektion) und/oder unter die Haut (subkutane Injektion).
Diese Hormone werden zum größten Teil als Injektion entweder in den Muskel (d.h. intramuskuläre) oder unter die Haut (d.h. subkutan/subcutan) verabreicht.
Intramuskuläre Injektion (i.m.)
Als intramuskuläre Injektion bezeichnet man das Einbringen eines flüssigen Arzneimittels in einen Skelettmuskel mittels Spritze und Kanüle. Medikamente, die Sie intramuskulär injizieren sollten sind folgende: Gonadotropine (z.B. Merional, Menogon, Menopur), Humanes Choriongonadotropin (z.B. Pregnyl (A, CH) = Predalon (D), Brevactid, Gonasi), Progesteron (z.B. Agolutin, Gestone, Prontogest, Progesteron Streuli)
Injektionsnadeln:
Zum Auflösen des Medikaments verwenden Sie die Nadeln 18G / 1,2 x 40mm. Zur intramuskulären Injektion verwenden Sie die grüne Nadel 21G / 0,8 x 40mm.
Durchführung der intramuskulären Injektion:
- Bestimmung des Injektionsortes
- Herstellen der Injektionslösung (bei Trockensubstanzen z.B. Merional, Fostimon, Menogon, Menopur, Pregnyl etc): Das Medikament befindet sich in der Trockensubstanz, die Flüssigkeit dient als Lösungsmittel. Spritzen Sie die Flüssigkeit in die Trockensubstanz, diese löst sich sofort auf und kann wieder in die Spritze aufgezogen werden. Verwenden Sie bitte jeweils die gleiche Anzahl Ampullen mit Flüssigkeit bzw. Trockensubstanz, z.B. 3 Trockensubstanzen mit 3 Flüssigkeiten auflösen.
- Desinfektion der Punktionsstelle
- Einwirkzeit des Desinfektionsmittels abwarten (ca. 30-60 Sekunden)
- Injektionsnadel wechseln (zur Injektion grüne Nadel verwenden, Nadel und Kanüle fest zusammenstecken!)
- zügig senkrecht Einstechen (90°) - Kanüle NICHT ganz einführen, langsam injizieren!
Subkutane Injektion
Der Begriff subkutan steht für eine anatomische Ortsangabe, die sich auf das Gewebe „unter der Haut“ bezieht. Diese Unterhaut besteht im Wesentlichen aus dem unmittelbar unter der Haut liegenden Binde- und Fettgewebe. Medikamente, die Sie subkutan injizieren sollten sind folgende: GNRH-Agonist und -Antagonist (z.B. Decapeptyl, Orgalutran, Cetrotide), Gonadotropine (z.B. Puregon, Gonal F, Fostimon)
Injektionsnadeln:
Zum Auflösen des Medikaments verwenden Sie die Nadeln 18G / 1,2 x 40mm. Zur subkutanen Injektion verwenden Sie die kurze Nadel 27G / 0,40 x 20mm. Bei Puregon und Gonal-F mittels Pen sind eigene Nadeln vorhanden (z.B. 29G / 0,33 x 12mm oder BD Micro-Fine Pen-Nadel)
Durchführung der subkutanen Injektion:
- Bestimmung des Injektionsortes: Sie können entweder in die Bauchdecke unterhalb des Nabels oder am Oberschenkel injizieren. Um zu gewährleisten, dass die Injektion im Subkutangewebe und nicht im Muskelgewebe erfolgt, wird eine Hautfalte gebildet und in diese injiziert. Die Injektion kann in einem Winkel von 45°-90° erfolgen.
- Herstellen der Injektionslösung: bei Trockensubstanzen siehe Punkt 1.2 bei der intramuskulären Injektion. Teilweise sind die Injektionen schon als fertige Injektionslösungen vorhanden. Für Puregon oder Gonal-F gibt es eigene Pen’s zur Verabreichung: siehe Gebrauchsinformation (Packungsbeilage)
- Desinfektion der Punktionsstelle
- Einwirkzeit des Desinfektionsmittels abwarten (ca. 30-60 Sekunden)
- Injektionsnadel wechseln (zur Injektion graue Nadel verwenden, Nadel und Kanüle fest zusammenstecken!) / für Puregon und Gonal F Pens 29G / 0,33 x 12mm bzw. BD Micro-Fine Pen-Nadel
- Zügig in 45° Winkel einstechen, Spritzenstempel zurückziehen und langsam injizieren.
Stimulationskontrolle & Ovulationsinduktion: Ein besonderes Handwerk
Eine adäquate Stimulation ist das „A und O“ einer IVF-Therapie. Wird der Eierstock zu wenig stimuliert, besteht die Gefahr, dass die Follikel nicht weiterwachsen und quasi „verhungern“. Ist die Stimulation zu stark, besteht gegebenenfalls das Risiko einer Überstimulation. Auch der Zeitpunkt der Ovulationsinduktion (das Setzen des Triggers zur finalen Eizellreifung durch hcg oder eines Agonisten im Antagonistenprotokoll) ist ganz entscheidend. Erfolgt dieser zu früh oder zu spät bzw. sind die Follikel zu groß oder zu klein kann das die Befruchtungsfähigkeit, die Entwicklungskompetenz des Embryos und damit den IVF-Erfolg nachhaltig beeinträchtigen.
Das Problem jeder ovariellen Stimulation, die zu einem multifollikulären Wachstum führt, ist die Tatsache, dass während der Stimulation Follikel unterschiedlicher Größe vorliegen und dass die Follikelgröße bei einem multifollikulären Wachstum oft schwer zu bestimmen ist.
Um die Follikelgröße akkurat zu überprüfen (Follikelmonitoring) verwenden wir modernste 3D Ultraschallverfahren. Nur diese sind zur präzisen und automatisierten Vermessung der Follikel geeignet. Dabei lassen sich Volumen und Größe der heranreifenden Follikel und damit auch indirekt deren Reifegrad bestimmen. Diese Ultraschallkontrolle erfolgt in regelmäßigen Abständen über den gesamten Zeitraum der Stimulationsphase. Ziel ist es, den optimalen Zeitpunkt für die Gabe des Auslöse-Hormons HCG und die anschließende Follikelpunktion zu ermitteln.
Schon gewusst?
Seit vielen Jahren widmen wir uns der Optimierung ovarieller Stimulationsprotokolle im Rahmen der IVF. Ebenso gehört das 3D- Ultraschall-basierte Follikelmonitoring und auch generell die Anwendung der 3D Sonographie in der reproduktionsmedizinischen Diagnostik zu unseren Kernkompetenzen. Gemäß unserem Leitmotiv „Der Exzellenz verpflichtet“ können wir unsere Expertise anhand zahlreicher wissenschaftlicher Arbeiten, Fachbücher und Kongressbeiträge belegen (siehe Publikationen, Fachbücher & Kongressbeiträge).
Darüber bieten wir seit vielen Jahren zertifizierte 3D Sonogrophie-Workshops mit Hands-On Training für niedergelassene Gynäkolog/innen; Reproduktionsmediziner/innen mit Erfolg an.
Verringert sich durch die Stimulation die ovarielle Reserve? Komme ich durch die Stimulation vorzeitig in die Wechseljahre?
Nein, durch die hormonelle Stimulation der Follikel kommt man nicht, wie fälschlicherweise häufig angenommen, vorzeitig in die Wechseljahre. Auch die ovarielle Reserve verringert sich nicht. Bei der Stimulation und dem daraus resultierenden multifollikulärem Wachstum werden nur jene Follikel rekrutiert, die ohnehin bei dem Kampf um die Dominanz des Leitfollikel konkurrieren und somit auch untergehen würden.
Verursacht die Stimulation Beschwerden?
Die Risiken im Zusammenhang mit einer hormonellen Follikelstimulation sind minimal. Eine der seltenen Komplikationen ist dabei die Überstimulation (OHSS).
Hierbei können bei der sich die Eierstöcke vergrößern. Die Überstimulation äußert sich hauptsächlich durch Unwohlsein, Abgeschlagenheit, Gewichtszunahme, gelegentlich auch Schmerzen im Unterleib. Vereinzelt kann sich Flüssigkeit im Bauchraum (Aszites) ansammeln. Eine OHSS ist meist sellbstlimitierend, das heisst, die Überstimulation lässt mit der Zeit nach. Ruhe, die Zufuhr proteinreicher Nahrung und ausreichender Flüssigkeit verbessern die Situation. Gegebenenfalls sind ambulante Kontrollen nötig und gegebenenfalls eine sogenannte Aszitespunktion. Nur in seltenen Fällen ist ein kurzzeitiger stationärer Krankenhausaufenthalt nötig.
Eine Schwangerschaft nach hormoneller Stimulation und künstlicher Befruchtung unterscheidet sich nicht wesentlich von einer natürlich-konzipierten Schwangerschaft und ist mit etwa den gleichen Risiken (vorzeitige Wehen, Fehlgeburten usw.) verbunden
Kann man mit über 40 noch eine angemessene Anzahl an Follikeln bei einer Stimulation erwarten?
Mit zunehmendem Alter sinkt die ovarielle Reserve der Frau- ab Mitte 30 schwindet die Funktionsfähigkeit der Ovarien sogar sprunghaft. Ob und wie viele Follikel, respektive Eizellen zu erwarten sind hängt neben dem Alter von einer ganzen Reihe individueller Faktoren ab. Prädiktiv für die Anzahl der zu erwartenden Eizellen ist die über den antralen Follikelcount bestimmte ovarielle Reserve. Dies nimmt mit dem Alter ab, aber nicht alle Frauen haben mit 40 eine „niedrige ovarielle Reserve“. Umgekehrt die die ovarielle Reserve im Sinne des AFC oder der AMH-Wert nicht unbedingt prädiktiv für die Eizellkompetenz und die Anzahl der entstehenden Blastozysten
Was ist bei einer Follikelstimulation im Rahmen einer Insemination besser: Letrozol oder Clomiphen?
Die Anwendung von Clomiphen gilt immer noch als Standardtherapie bei Ovulationsinduktion Letrozol gilt hingegen als sogenannte Off-label Use. In der Anwendung sind die jedoch ähnlich effektiv, wobei nach der derzeitigen Datenlage Letrozol im Vergleich zu Clomifencitrat mit verbesserten Ovulations-, Schwangerschafts- und Lebendgeburtenraten verbunden so sein scheint.
Ist eine IVF ohne vorhandene Eileiter / mit nur einem Eierstock /ohne Uterus möglich?
Wenn keine Eileiter vorhanden, diese mittels einer Tubenligatur unterbrochen wurden oder diese nicht durchgängig sind, ist eine Stimulation mit anschliessender IVF der einzige Weg zur Erfüllung des Kinderwunsches und somit klar indiziert. Auch so lange mindestens ein Eierstock vorhanden ist, ist eine Stimulation auch möglich. Auch bei einem Fehlen des Uterus ist eine Follikelstimulation und eine Follikelpunktion möglich, jedoch würde zum Erreichen einer Schwangerschaft eine Leihmutter benötigt. Eine Leihmutterschaft ist nach Schweizer Recht verboten!
Kann ich die Stimulationskontrolle mittels Ultraschalls auch extern durchführen?
Ja, dies ist durchaus möglich, dass Sie die Stimulationskontrolle bei Ihrem Gynäkologen durchführen
Können wir während der Stimulation Geschlechtsverkehr haben?
Wichtig ist es, zum Zeitraum der Auslösespritze auf den Geschlechtsverkehr zu verzichten
Kann eine IVF auch ohne Stimulation durchgeführt werden?
Theoretisch ja. Hier spricht man dann vom natürlichen Zyklus. Die Erfolgschancen sind hier deutlich geringer, was darauf zurückzuführen ist, dass im natürlichen Zyklus nur eine einzige Eizelle heranreift. Darüber hinaus bedarf es ein engmaschiges Monitoring, um den Zeitpunkt des Eisprunges nicht zu verpassen, da dieser im natürlichen Zyklus nicht von aussen induziert wird.
Bekommt man durch eine IVF-Stimulation mehr chromsomal-abnormale Eizellen?
Nein, immer wieder geistern Gerüchte und Aussagen durch das Internet, dass ein natürlicher Zyklus oder eine niedrig dosierte Stimulation zu qualitativ besseren Eizellen, und weniger Aneuploiden führt. Diese Aussage ist wissenschaftlich nicht haltbar. Obwohl vor einigen Jahren vermutet, lasst sich dies nicht anhand der gegenwärtigen Datenlage belegen und ist wohl nicht mehr als ein Mythos. Umgekehrt sinkt der IVF-Erfolg bei einer milden Stimulation oder im natürlichen Zyklus bei der nur eine oder wenige Eizellen heranreifen. Schliesslich entwickelt sich nicht jede befruchtete Eizelle zu einer transferierbaren Blastozyste.
Wie lange dauert eine Stimulation?
Die Gesamtdauer der Stimulation ist abhängig vom verwendeten Protokoll und auch dann kann die Stimulationsdauer individuell um wenige Tage variieren.
Dreidimensionale Sonographie
Für eine erfolgreiche Kinderwunschbehandlung sind Ultraschall (Sonographie) Untersuchungen unerlässlich. Dabei spielt der Ultraschall nicht nur bei der Stimulationsüberwachung eine wichtige Rolle, sondern wird zunehmend in allen wesentlichen diagnostischen Abklärungsschritten eingesetzt.
Auf die Technik kommt es an
Bei der 3D Sonographie wird aus mehreren zweidimensionalen Schnittbilddaten eine dreidimensionale Volumengraphik errechnet. Der Vorteil liegt dabei klar auf der Hand. Durch die 3D Struktur lassen sich Messungen mit größerer Genauigkeit vornehmen und Strukturen innerhalb des dreidimensionalen Bildes besser betrachten. Genau aus diesem Grund ist die 3D Sonographie aus vielen medizinischen Fachgebieten nicht mehr weg zu denken. Dazu gehört beispielsweise die Kardiologie oder die Pränataldiagnostik.
In der Reproduktionsmedizin setzt sich diese Technologie erst allmählich durch. Dabei sind und waren wir Vorreiter, wenn es um den Einsatz dieser innovativen Technik geht, die wir bereits seit 2009 einsetzen. Mehr unter: Höhere Befruchtungsraten durch 3D-Ultraschall
Auch ganz entscheidend waren wir beteiligt an der Entwicklung von 3D Ultraschallverfahren zur präzisen und automatisierten Vermessung von Follikeln in der Stimulationskontrolle. Unsere Expertise auf dem Gebiet der 3D Sonographie spiegelt sich dabei in zahlreichenwissenschaftlichen Arbeiten, Fachbüchern und Kongressbeiträge wider. Mehr unter: Wissenschaftliche Publikationen zum Einsatz der 3D Sonographie in der Reproduktionsmedizin
Darüber hinaus bieten wir seit mehreren Jahren zertifizierte Sonogrophiekurse mit Hands-On Training für niedergelassene Gynäkologinnen /und Gynäkologen an.
Mehr unter: 3D-Ultraschallkurs für die gynäkologische Praxis
Diagnostik
In der Diagnostik setzt sich die 3D Sonographie aufgrund einer besseren räumlichen Orientierung immer mehr als Mittel der Wahl bei der Erstdiagnose von uterinen Fehlbildungen durch. Auch bei erworbenen uterinen Anomalien wie bei der Darstellung von Uterusmyomen, endometrialen Polypen, Adenomyose (Leiomyome), intrauterinen Adhäsionen und bei der Vermessung von Narbengewebe eines Kaiserschnittes schneidet der dreidimensionale Ultraschall deutlich besser ab.
Ebenso unschlagbar ist die transvaginale 3D Sonographie bei der Bestimmung der ovariellen Reserve oder bei der Darstellung polyzystischer Ovarien.
Therapie
Ein Ultraschallmonitoring ist bei allen Stimulationstherapien obligat. Gerade wenn mehrere Follikel heranreifen, ist sowohl die Quantifizierung als auch die exakte Größenbestimmung mit der 3D Sonographie deutlich besser. Eine genaue Größenbestimmung der Follikel als auch die Bestimmung der Follikelzahl sind entscheidend für die Anpassung der Stimulationstherapie als auch für die Bestimmung des idealen Zeitpunkts der Trigger-Gabezur Auslösung der Eizellreife. Wird zu früh oder zu spät ausgelöst kann dies den Erfolg einer Kinderwunschtherapie massgeblich verringern. Wesentlich ist auch die deutlich verkürzte Untersuchungszeit beider 3D Sonographie-ganz zum Vorteil unserer Kinderwunschpaare.
Schon gewusst?
Unter Stimulationsbedingungen befinden sich in den Eierstöckern immer Follikel unterschiedlicher Größe. Die Follikelgröße lässt auch Rückschlüsse auf Eizellreife, Befruchtungs- und Entwicklungskompetenz der Eizelle zu. Daraus ergibt sich die Frage, wann am besten die Triggergabe zur finalen Eizellreifung gegeben werden sollte. Den genaue Ultrasonographie festgelegte Zeitpunkt zur Trigger Gabe konnten wir dabei durch eine eigene Studie bestimmen.
