Befruchtung der Eizelle
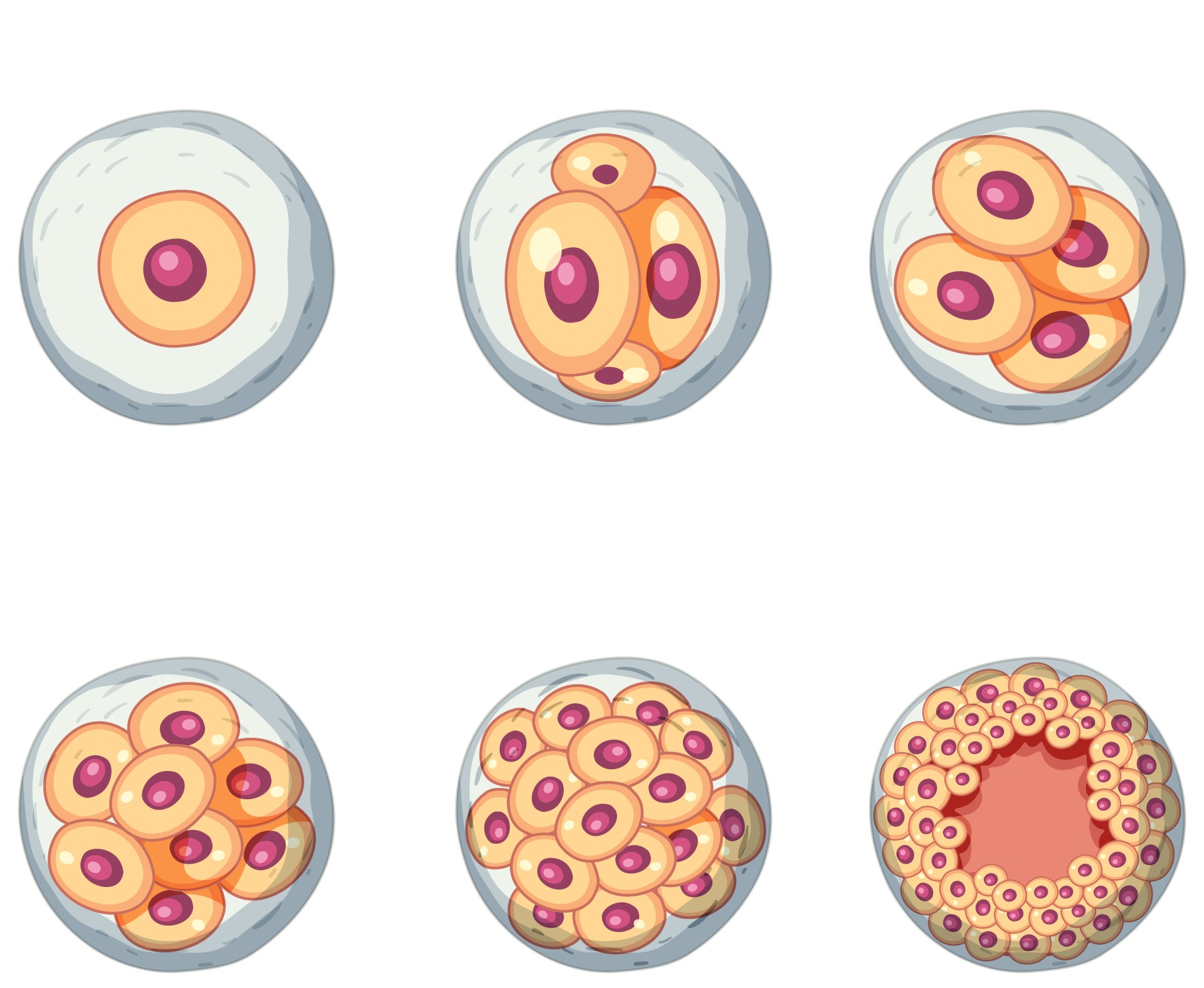
In-vitro-Fertilisation
Bei der In-vitro- Fertilisation erfolgt eine Befruchtung und die anschliessende Embryonalentwicklung der ersten 5-6 Tage ausserhalb des Körpers. Anschliessend erfolgt der Embryotransfer. Dazu müssen dem Eierstock Eizellen entnommen werden. Dies geschieht in der Regel nach einer hormonellen Stimulation im Rahmen eines individuell abstimmten Stimulationsprotokolls.
Es gibt zur Fertilisierung zwei Möglichkeiten:
Klassische IVF: Hierbei wird die Eizelle mit den aufbereiteten Samenzellen in vitro in Kontakt gebracht. Ziel ist das selbstständige Eindringen des Spermiums in die Eizelle und die Vereinigung zur Zygote.
IVF/ICSI:
Seit ihrer Erstanwendung im Jahr 1992 ist die ICSI ein integraler und elementarer Bestandteil reproduktionsmedizinischer Massnahmen. Hierbei wird ein Spermium ausgewählt und mittelseiner Injektionsnadel direkt in die Eizelle injiziert.
Die Embryonalentwicklung kann mittels moderner Labortechnik detailliert beobachtet und nach morphologischen oder morphokinetischen Kriterien beurteilt werden. Hat der Embryo das Blasozystensstadium erreicht und sind die Implantationschancen gegeben, wird dieser in die Gebärmutter der Frau eingebracht (siehe „Embryotransfer„). DIE ICSI(Intracytoplasmische Spermieninjektion) Methode kommt insbesondere bei einem männlichen Infertilitätsfaktor zur Anwendung. Bei einer schwergradigen männlichen Fertilitätsproblematik wie bei einer Azoospermie, einer Globozoospermie aber auch bei stark eingeschränkten Fertilitätsparametern ist sie die einzige Option im Rahmen einer Kinderwunschbehandlung.
Welche Methode zur Fertilisierung zur Anwendung sinnvoll ist, erfahren Sie nach Rücksprache mit dem behandelnden Arzt.
IVF/IMSI:
Die IMSI ist eine Weiterentwicklung der ICSI. Die IMSI greift dabei auf hochauflösende Mikroskopiertechniken zurück und erlaubt damit eine weitere und bessere Beurteilung der auszuwählenden Spermien anhand feinmorphologischer Kriterien– (siehe auch Spermienauswahl).
Warum IMSI statt ICSI?
Spermienmorphologie
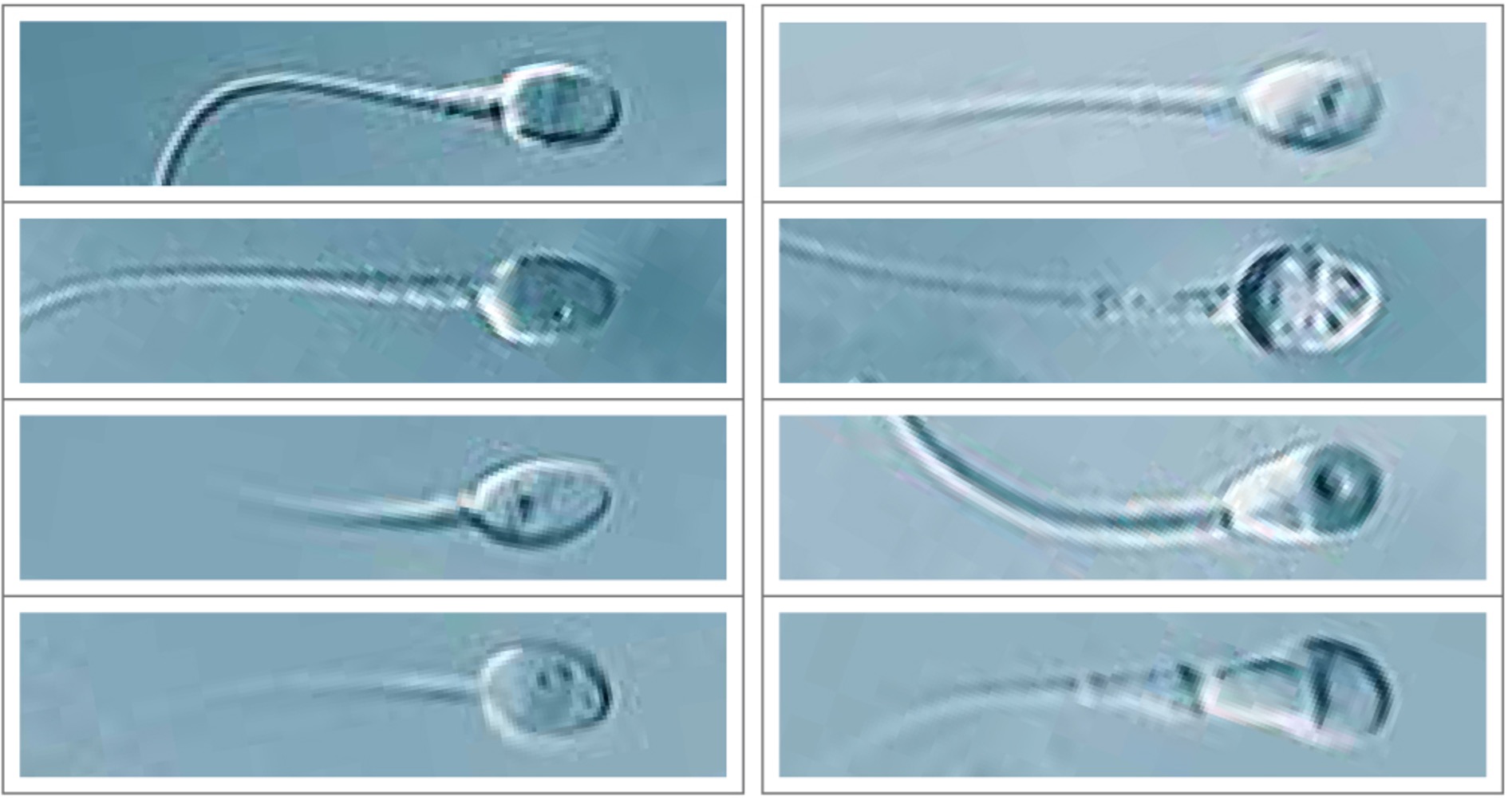
Unter der Spermienmorphologie versteht man das Aussehen und Form der Spermien, wie sie unter dem Mikroskop zu betrachten sind. Nicht alle Spermien sehen gleich aus. Größe und Aussehen der Spermien variieren stark, und auch nicht wenige Spermien weisen eine abnormale Morphologie auf. Abnormalitäten an den Spermien können den Kopfteil, das Mittelstück oder die Geisel betreffen. Die WHO hat 2010 Grenzwerte für normal geformte Spermien festgelegt. Dabei sollten mindestens 4% eine normale Form aufweisen. Liegen bei einem Spermiogramm mehr als 96% der Spermien als abnormale Formen vor spricht von einer Teratozoospermie. Eine Teratozoospemie gilt als eine Unfruchtbarkeitsursache. Meist liegt eine Teratozoospermie auch nicht allein vor, sondern ist mit anderen Infertilitätsparametern verknüpft wie etwa einer reduzierten Beweglichkeit(Asthenozoospermie) oder einer verringerten Anzahl an Spermien (Oligozoospermie). ImAllgemeinen geht man davon aus, dass Spermien mit normaler Morphologie, eine bessere Motilität aufweisen, besser eine Eizelle befruchten können und die weitere Embryonalentwicklung auch besser verläuft.
Die Ursache für morphologische Veränderungen an den Spermien ist nicht eindeutig geklärt. Und wahrscheinlich sind je nach Art der Malformation unterschiedliche Faktoren in Betracht zu ziehen.
Bei einer ICSI wird erfahrungsgemäß versucht möglichst morphologisch normale Spermien für die Injektion in die Eizelle zu selektieren. Nun ist es so, je näher man sich etwas ansieht, desto besser kann man auch daessen Aussehen beurteilen. Bei einer herkömmlichen ICSI werden die Spermien unter einer 200-400x Vergrößerung im Mikroskop ausgewählt. Durch die Einführung von Hochleistungsmikroskopen können Spermien mittlerweile in einer Vergrößerung von 600 -12000x betrachtet und selektiert werden. Dabei könnenmorphologische Veränderungen an den Spermien erfasst werden, die unter einem normalen Mikroskop nicht erkennbar wären. Die Intrazytoplasmisch morphologisch selektierte Spermieninjektion, kurz IMSI verwendet diese hochauflösenden Mikroskope und ist somiteine Art Weiterentwicklung der ICSI. Die Methode IMSI soll somit garantieren, dass besonders gute Spermien für die Befruchtung verwendet werden und die Chancen auf eine Schwangerschaft und Geburt eines gesunden Kindes steigen.
Vorteile der IMSI
Die Beurteilung der Spermienqualität kann durch moderne Mikroskopiertechniken, wie die IMSI, zusätzlich verbessert werden. Mit einem hochauflösenden Spezial-Mikroskop werden die Spermien mit 6.000-12.000-facher Vergrößerung dreidimensional in Echtzeit, also „live“, analysiert. Damit können diese Spermien wesentlich genauer untersucht und für die Befruchtung der Eizelle ausgewählt werden, vor allem im Hinblick auf deren Form und Struktur.
Seit der Entwicklung der IMSI-Methode durch den israelischen Biochemiker und Andrologen, Professor Benjamin Bartoov, ist und bleibt die IMSI eine der wenigen Methoden, die ein Real-Time-Spermienscreening ohne Färbung und die gezielte Selektion von Samenzellen mit bestmöglicher morphologischer Integrität ermöglichen.
Blastozystenkultur
Unter einer Blastozystenkultur versteht man die Kultivierung von Embryonen bis ins sogenannte Blastozystenstadium. in diesem befindet sich der heranwachsende Embryo am 5. Entwicklungstag nach der Befruchtung (Fertilisierung). Die Blastozystenkultur mit Beurteilung der Embryoqualität sind seit fast 3 Jahrzehnten integraler Bestandteile unserer Laborarbeit. Damit waren wir einer der „Ersten“, die diese auch implementiert haben. Dabei stand lange zur Diskussion, ob eine Blastozystenkultur mit einem „Tag 5 Transfer“ überhaupt einen Nutzen bringt oder vielleicht sogar eher schadet (Stichwort: epigenetische Veränderungen).
Mittlerweile zeigen aber große Meta-analysen und Übersichtsarbeiten, dass:
- die IVF-Erfolgsraten bei einem Transfer von Blastozysten höher ist als bei einem Transfer von frühen Teilungsstadien (Tag 2, Tag 3 Transfer)
- die Synchronisation zwischen Embryo und Emdometrium (Gebärmutterschleimhaut) besser ist bei einem Tag 5/6 Transfer als am Tag 2 oder 3
- damit verbunden die Gefahr einer ektopen Schwangerschaft (Schwangerschaft ausserhalb der Gebärmutter wie etwa einer Eileiterschwangerschaft) mit dem Blastozystentransfer sinkt
- aufgrund eines natürlichen Selektionsprozesses der Anteil an chromosomalen Mosaiken und chromosomal abnormalen Embryonen im Blastozystenstadium geringer ist
Gleichzeitig geben eine Vielzahl fundierter Studien Hinweise darauf, dass:
- das Entwicklungspotential des Embryos im Blastozystenstadium besser abzuschätzen ist. Somit können jene Embryonen zum Transfer ausgewählt werden, welche ein optimales Entwicklungs- und Einnistungspotential aufweisen.
- ie uterine Kontraktion am Tag 5 der Embryonalentwicklung geringer ist und damit auch das Risiko, dass der Embryo abgestossen wird.
- Kein erhöhtes Risiko für epigenetische Veränderungen durch die Blastozystenkultur besteht
- Und dass das die Blastozystenkultur nicht mit höheren Schwangerschaftsrisiken und Geburtsrisiken verbunden ist.
Ablauf
Ablauf:
Nach der Eizellentnahme erfolgt die Befruchtung der Eizellen mit den Spermien im Labor (IVF/ICSI/IMSI). Die befruchteten Eizellen werden in einen Inkubator („Brutschrank“) gegeben, wo sie in einem speziellen Kulturmedium zu Embryonen heranwachsen. Die Embryonalentwicklung kann mittels modernster Labortechnik sehr genau beobachtet und beurteilt werden. Haben die Embryonen ein bestimmtes Entwicklungsstadium (Blastozyste = einnistungsfähiger Embryo) erreicht, werden jene Embryonen (max. 2) ausgewählt und in die Gebärmutter der Frau eingebracht, welche das höchste Einnistungspotential aufweisen (siehe „Embryo-Transfer“).
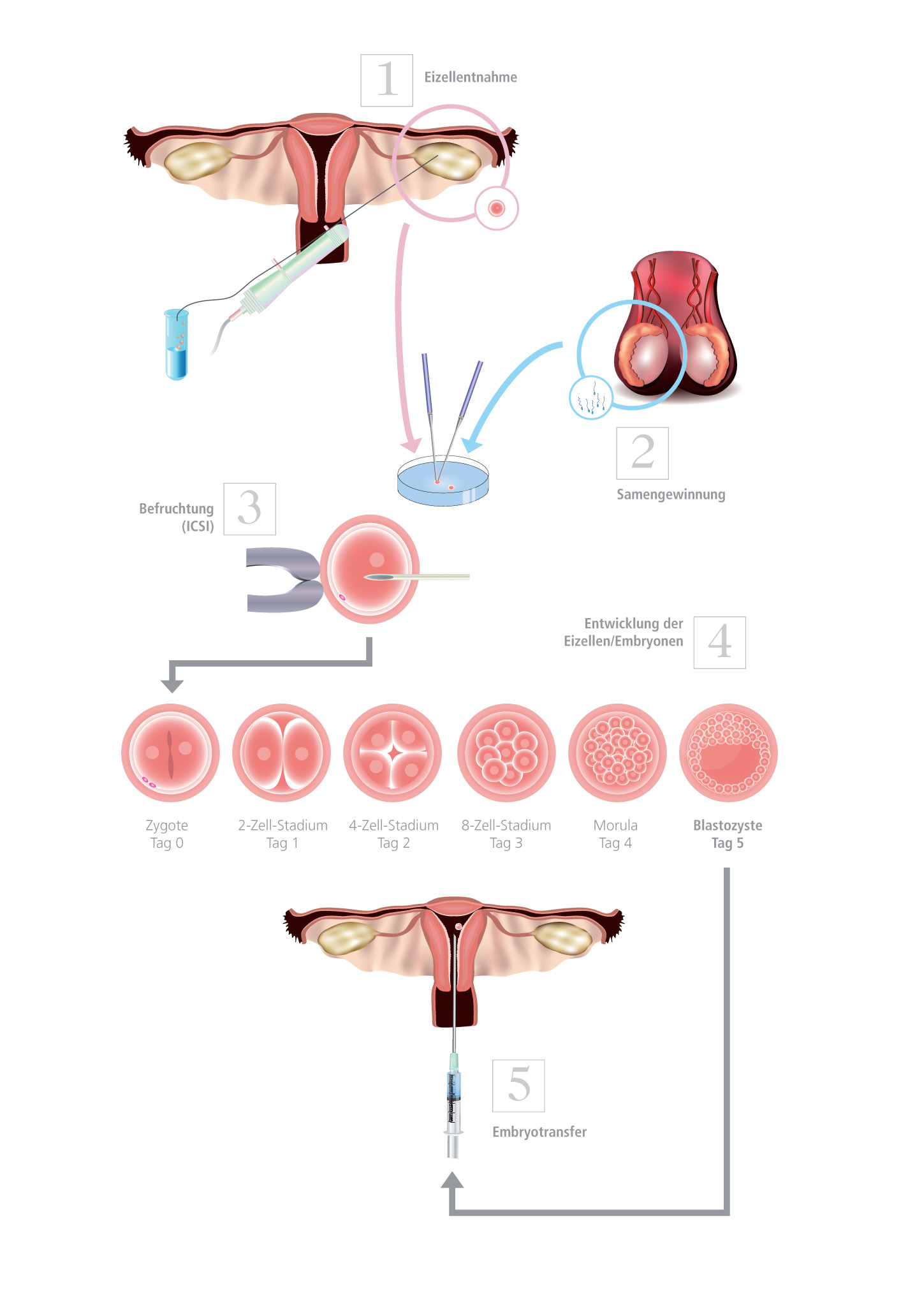

Hinweis
In der Schweiz dürfen auf diese Weise innerhalb eines Behandlungszyklus maximal zwölf Embryonen erzeugt werden.
Warum ist ein Embryo-Transfer im Blastozystenstadium sinnvoll?
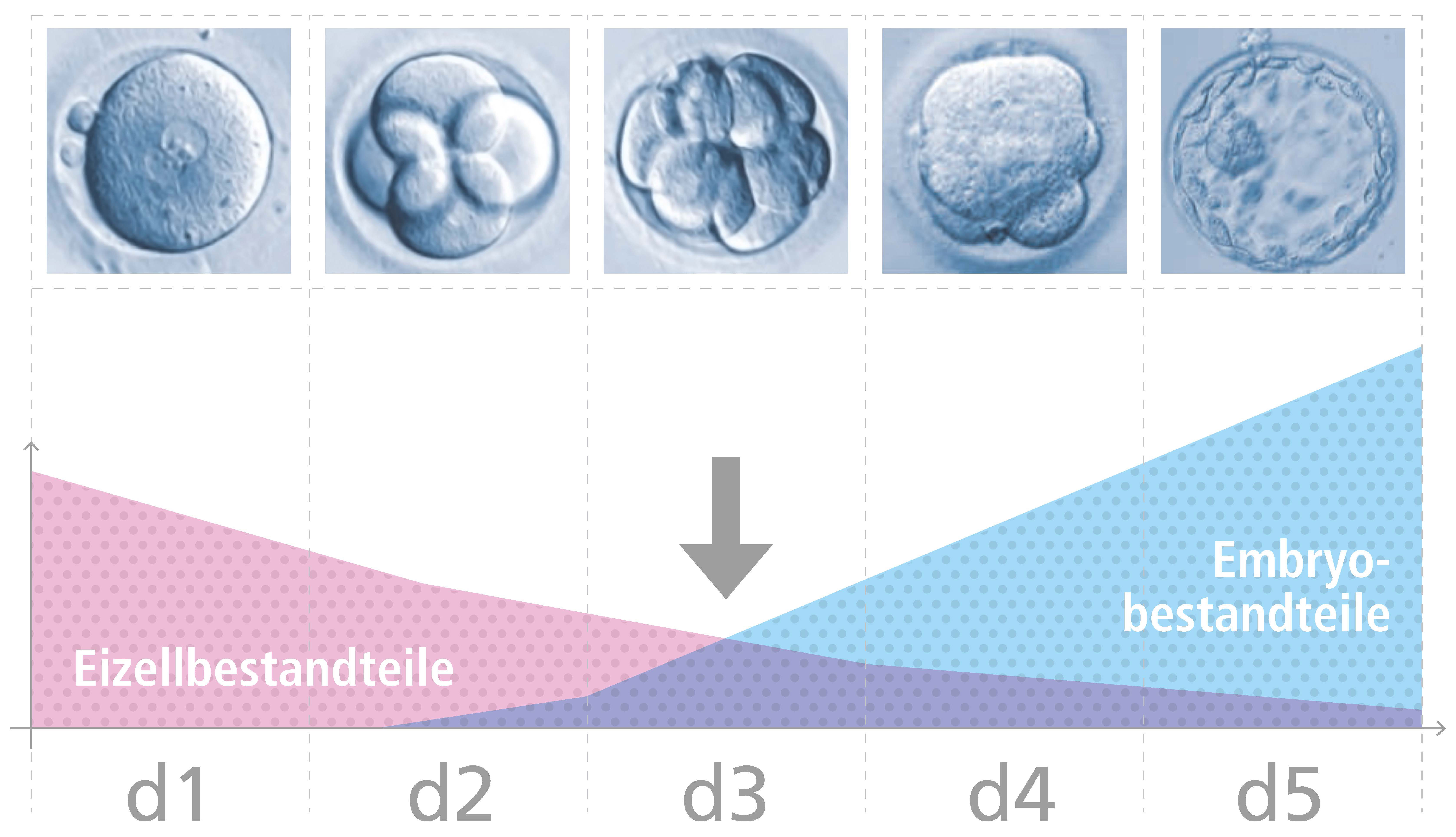
Bei Befruchtung vereinigen sich zwei hoch spezialisierte Zellen, die Eizelle und Spermium, zu einen völlig neuen Organismus mit eigenem Genom (Erbgut). Am Tag 3 der Embryonalentwicklung wird dieses neue, embryonale Genom sozusagen „angeschaltet“. Denn zwischen der Befruchtung und diesem Zeitpunkt ist das aus dem Erbgut von Mutter und Vater neu entstandene Genom noch nicht aktiv.
Die Zygote und die ersten embryonalen Teilungsstadien produzieren keine eigene RNA und damit auch keine eigenen Proteine (Eiweiße). Dieser frühe Embryo überlebt nur, indem er auf maternale RNA und Proteine der Mutter zurückgreift, die zuvor in der Eizelle eingelagert wurden. Diese von der Mutter bereitgestellten Eiweiße sind auch für die „Vorbereitung“ bzw. Reorganisation des zygotischenGenoms verantwortlich, damit es später aktiviert werden und seine eigene RNA und Eiweiße produzieren kann. Ab Tag 3 der Embryonalentwicklung ist der Embryo quasi auf sich gestellt.Tatsächlich weisen aber viele frühe Embryonalstadien Fehler im Genom auf. Es fehlen Teile des Genoms, einige sind zu viel (sogenannte chromosomale Fehlverteilungen). Dies stört die korrekten Entwicklungsabläufe im Embryo.
Fehlen nun bestimmte Gene oder sind einige zu viel, stört dies die Embryonalentwicklung. Es kommt zu einer Wachstumsretadierung oder zu einem Absterben des Embryos.
Diese Fehlverteilungen sind übrigens nachweislich nicht der IVF geschuldet, sondern ein natürlicher Prozess. Ebenso natürlich ist die Tatsache, dass deswegen nur ein Teil der Embryonen das Blastozystenstadium erreicht. Ein noch kleinerer Teil der Blastozysten weist dabei eine gute Qualität nach Gardner Kriterien auf. Dies sind oft -wenn auch nicht immer- die genetisch weitgehend intakten Embryonen. Viele Embryonen, oft jene mit schwereren Defekten arretieren in ihrer Entwicklung. Dies kann auch Embryonen beinhalten, die am Tag 2 oder 3 morphologisch vollkommen normal aussehen. Die Blastozystenentwicklung stellt damit einen natürlichen Selektionsprozess dar, den wir uns in der Reproduktionsmedizin zu Nutze machen.
Die Blastozystenkultur ermöglich auch den elektiven Single Embryo Transfer, kurz SET. Dadurch, dass nur ein einzelner Embryo mit hohem Entwicklungspotential ausgewählt und in die Gebärmutter transferiert wird, werden die Risiken einer Mehrlingsschwangerschaft deutlich verringert.
Übrigens auch bei einer Präimplantationsdiagnostik (PID) / Pre-implantation Genetic Testing (PGT) ist eine Blastozystenkultur notwendig. Zur genetischen Untersuchung von Zellen eines Embryos gilt die Trophektodermbiopsie als die sicherste und beste verfügbare Methode.
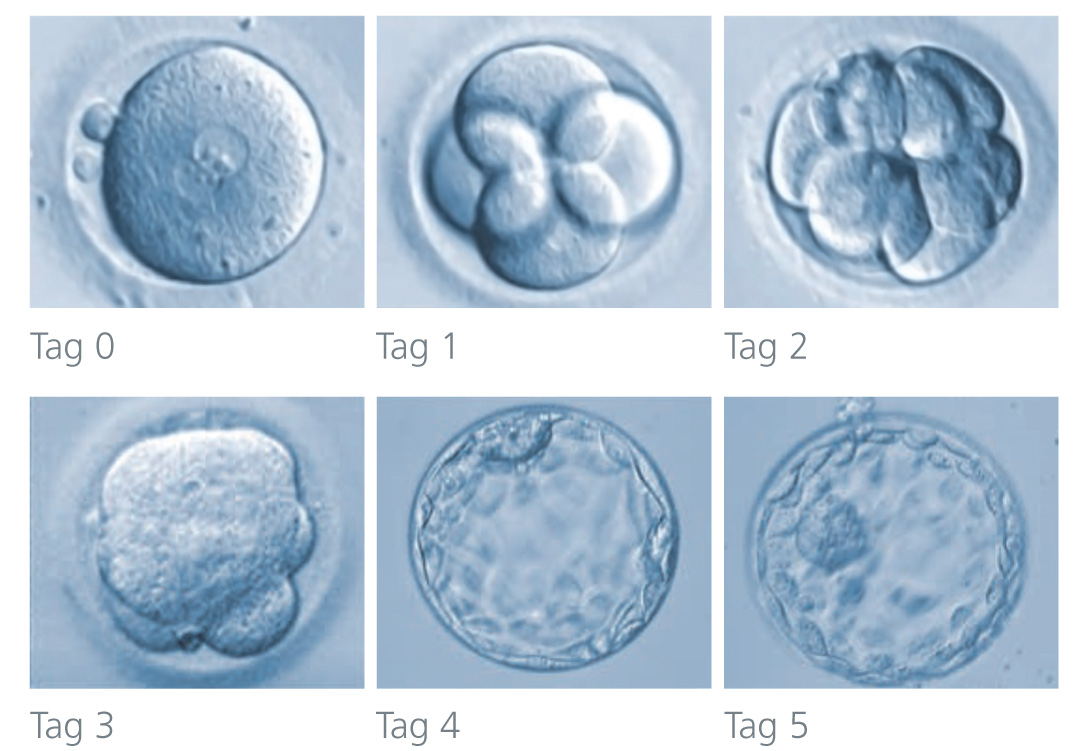
Haben die Embryonen ein bestimmtes Entwicklungsstadium (Blastozyste = einnistungsfähiger Embryo) erreicht, werden diese in die Gebärmutter der Frau eingebracht (siehe „Embryo-Transfer“). Dies erfolgt idealerweise am 5. Tag, gegebenenfalls auch am Tag 6 nach der Befruchtung, was jenem Zeitpunkt entspricht, an dem ein Embryo bei natürlicher Fortpflanzung vom Eileiter in die Gebärmutter gewandert ist und sich dann einnistet (Embryonale-endometriale Synchronisation). Unsere eigenen Daten zeigen, dass eine Optimierung dieses Synchronisationsprozesses das Risiko einer extrauterinen Schwangerschaft (etwa einer Eileiterschwangerschaft) deutlich minimiert!
Vorteile einer Blastozystenkultur
- Morphologisch-basierte Selektion des Embryos am Tag 5/6 ist genauer als am Tag 2/3
- Bessere Chancen auf eine Schwangerschaft
- Blatozystentransfer ist physiologischer
- Trophektodermbiopsie Im Rahmen einer PID möglich
- Elektiver Single-Embryo Transfer (SET) möglich
Gibt es denn auch Nachteile bei der Blastozystenkultur?
Eine Blastozystenkultur ist deutlich anspruchsvoller und setzt ein erfahrenes Laborteam und entsprechendes Know-how voraus.
Des Weiteren besteht hin und wieder die Gefahr, dass möglicherweise kein Embryo das Blastozystenstadium erreicht (Abbruchrisiko). Dies gilt insbesondere für Patientinnen mit höherem Alter, insbesondere dann, wenn dann nur wenige Eizellen bei der Punktion gewonnen werden können. Aus diesem Grund transferieren viele IVF-Zentren diesen Patientinnen die Embryonen oft am Tag 3. Jedoch sind unter diesen Voraussetzungen die Chancen auf eine intakte Schwangerschaft als gering anzusehen.
Haben die Embryonen ein bestimmtes Entwicklungsstadium (Blastozyste = einnistungsfähiger Embryo) erreicht, werden diese in die Gebärmutter der Frau eingebracht (siehe „Embryo-Transfer“). Dies erfolgt idealerweise am 5. Tag, gegebenenfalls auch am Tag 6 nach der Befruchtung, was jenem Zeitpunkt entspricht, an dem ein Embryo bei natürlicher Fortpflanzung vom Eileiter in die Gebärmutter gewandert ist und sich dann einnistet (Embryonale-endometriale Synchronisation). Unsere eigenen Daten zeigen, dass eine Optimierung dieses Synchronisationsprozesses das Risiko einer extrauterinen Schwangerschaft (etwa einer Eileiterschwangerschaft) deutlich minimiert!
Wann ist eine Kryokonservierung wichtig für mich?
… bei einer Kinderwunschbehandlung
Im Verlauf einer Kinderwunschbehandlung können Situationen auftreten, die das Einfrieren von befruchteten Eizellen und Embryonen in bestimmten Entwicklungsstadien notwendig machen, z.B.:
- wenn der Aufbau der Gebärmutterschleimhaut (Endometrium) nach der erforderlichen hormonellen Stimulation nicht optimal verlaufen ist, und der Embryotransfer nicht sofort stattfinden kann
- wenn ein Überstimulationssyndrom (OHSS) aufgetreten ist
- bei genetischen Untersuchungen mittels PGD/PGS (international neue Begriffsbezeichnungen: PGT-A, PGT-M, PGT-SR)
- bei der Rückgabe von nicht mehr als 1 Embryo ("Single Embryo Transfer"), d.h. in Situationen, wo neben dem/den zu transferierenden Embryo/nen (max. 2) weitere Embryonen aus dem Therapie-Zyklus hervorgehen, werden diese kryokonserviert.
- bei primären Kryo-Zyklen
… für „Fertility Preservation“
Hier werden vorsorglich Maßnahmen ergriffen, um die Fruchtbarkeit im Zuge des Alterungsprozess oder im Falle einer schweren Erkrankung zu erhalten, z.B.:
- bevorstehende Bestrahlungs- oder Chemotherapie
- die Familienplanung erfolgt zu einem späteren Zeitpunkt
Tiefgefrieren von Samenzellen und Hodengewebe
permien können aus dem Ejakulat, dem Nebenhoden und aus Hoden gewonnen werden. Alle diese Spermien können tiefgefroren und so für eine Behandlung konserviert werden. Für Tumorpatienten ist es sinnvoll, vor einer Chemotherapie oder einer radiotherapeutischen Behandlung ein Samendepot anlegen zu lassen, um später auf Samenzellen für eine Kinderwunschbehandlung zurückgreifen zu können, sollte durch die Therapie das Hodengewebe geschädigt werden. Es ist wissenschaftlich belegt, dass die jeweilige Lagerungsdauer keinen Einfluss auf die Samenqualität haben. Fremdspender-Samen können ebenso eingefroren werden. Nach der Kryokonservierung wird der Spender, innerhalb einer festgelegten Zeitspanne, erneut auf spezifische Infektionsparameter entsprechend gesetzlichen Vorschriften untersucht. Erst wenn dieser Befund negativ ist, wird der Samen freigegeben.
Tiefgefrieren von unbefruchteten Eizellen
In medizinischen Situationen, wo die Eizellen der betroffenen Frau Schaden nehmen, z.B. durch eine bevorstehende Bestrahlungs- oder Chemotherapie, oder aber auch aufgrund von gesellschaftlichen Entwicklungen (sog. „später Kinderwunsch“), kann ein vorsorgliche Kryokonservierung der Eizellen zielführend sein (siehe „Eizellvorsorge“).
Tiefgefrieren von befruchteten Eizellen
Auch Eizellen im Vorkernstadium (Zygote) am Tag 1 der Entwicklung können sicher kryokonserviert werden. Die Auftau- und weitere Entwicklungsrate bis zur Blastozyste ist sehr gut.
Tiefgefrieren von Embryonen in verschiedenen Entwicklungsstadien
Wenn bei einer Kinderwunschbehadlung neben dem/den zu transferierenden Embryo/nen (max. 2) weitere Embryonen aus dem Therapie-Zyklus hervorgehen, werden diese kryokonserviert. Embryonen können in jedem Entwicklungsstadium (vom Tag 2 bis Tag 6) eingefroren werden
